Se puede confundir con: Zifio de Blainville
![]()
![]()
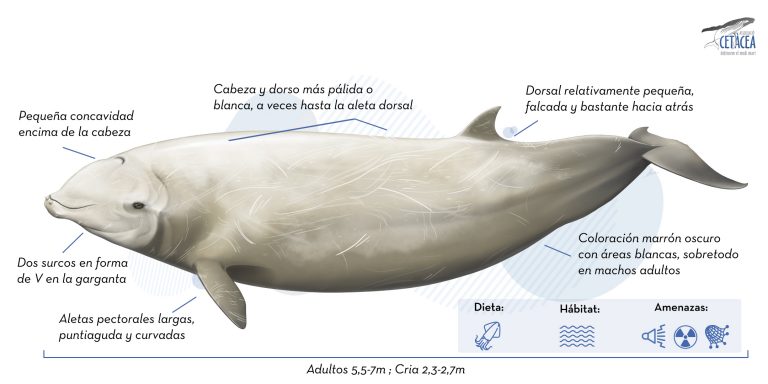
Presenta un cuerpo robusto, moderadamente largo y compacto, característico de la familia Ziphiidae. Ni el hocico o el melón están muy diferenciados, aunque en este último caso, puede llegar a ser más grande y bulboso en machos adultos. La línea de la boca es muy curvada. Como otros individuos de la familia, presenta dos “V” en forma de ranuras en la garganta. Una característica bastante distintiva es la presencia de una concavidad en la parte superior de la cabeza que se hace más fácil de detectar a medida que los individuos crecen. La aleta dorsal se dirige hacia atrás es pequeña y se encuentra bastante lejos de la cabeza, más o menos en los 2/3, en el eje longitudinal del cuerpo. La aleta caudal es grande y no siempre presenta muesca central. Las aletas pectorales son bastante pequeñas y pueden ser ocultadas en una depresión en el costado del cuerpo denominadas “flipper pockets”, probablemente para favorecer la hidrodinámica en la natación.
Es, sin duda, uno de los cetáceos con una mayor variabilidad en cuanto a su coloración, que puede ir desde el gris oscuro (especialmente en los machos adultos) a color marrón rojizo (en su mayoría hembras). Presentan dos áreas más claras alrededor de la cabeza y el estómago. En los adultos, la cabeza y parte del posterior de la espalda puede ser completamente blanca. Los ojos suelen estar rodeados generalmente por una pigmentación oscura. Con la edad presentan cada vez más heridas lineales y circulares u óvales, que estarían hechas por pequeños tiburones o lampreas.
Sólo cuentan con dos dientes cónicos, que miran hacia delante, en la parte anterior de la mandíbula inferior. Sólo son visibles en los machos adultos y en los ejemplares más grandes, incluso quedan expuestos fuera de la boca.
No hay diferencias significativas entre machos y hembras y el tamaño máximo es generalmente alrededor de 7 metros con un peso de aproximadamente 3.000 kg. Las crías miden entre 2.3 y 2.7 metros y pesan entre 250 y 300 kg.
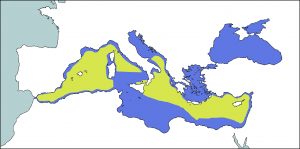
El zifio de Cuvier es la especie de la familia Ziphiidae, con una distribución más cosmopolita. Pueden encontrarse en todos los mares y océanos del mundo, de las regiones ecuatoriales y templadas cálidas a aguas más frías cerca de los polos tanto del hemisferio norte y el sur. No está presente en las aguas de latitudes muy altas. Muestra una clara preferencia por las aguas alejadas de la costa. También puede verse en muchos mares cerrados o semicerrados como el mar de Ojotsk, el Golfo de California, Golfo de México, el Caribe o el Mediterráneo (Jefferson et al., 2008; Taylor et al., 2008 & Perrin et al., 2009).
En este último, no se sabe con exactitud su distribución y la mayoría de los datos existentes provienen de individuos encontrados varados. Se cree que es frecuente tanto en el este como en la parte occidental de la cuenca, aunque se ha visto que hay cuatro áreas principales, el mar de Liguria (especialmente la parte oriental), el mar Tirreno, al este del mar de Alborán y noroeste del mar Egeo, y parece que zonas como el mar balear o el sur del mar Adriático podría ser favorable para la especie (Reeves and Notarbartolo di Sciara, 2006; Podestà et al., 2006; Holcer et al., 2007; Gannier and Epinat, 2008 & Gannier, 2011).
El zifio de Cuvier es considerado un animal oceánico que ocupa hábitats marcados por la topografía del fondo, pero que generalmente presentan zonas escarpadas y cañones submarinos. Generalmente no frecuenta zonas de aguas superficiales, ni tampoco ha sido visto a menudo en las aguas de los fondos abisales. Así, mostraría una preferencia por hábitats con profundidades sobre 500 o 600 metros, generalmente sobre 1.000 metros y con fuertes pendientes, como pueden encontrarse en los cañones submarinos o en el talud continental (Cañadas et al., 2002; Frantzis et al., 2003; Reeves and Notarbartolo di Sciara 2006; Azzellino et al., 2008; Gannier and Espinat, 2008 & Smith, 2010).
ESe cree que la principal presa del zifio de Cuvier es el calamar, aunque se han realizado pocos estudios sobre este tema. En las diferentes áreas del mundo, se ha visto que se alimentan principalmente de calamares oceánicos, especialmente de la familia Histioteuthidae, Cranchiidae o Gonatidae. Alternativamente, también se alimenta de crustáceos y peces, aunque serían mucho menos importantes (Fiscus, 1997; Santos et al., 2001; MacLeod et al., 2003 & Smith, 2010).
Existe bastante desconocimiento sobre la reproducción del zifio de Cuvier, debido a la dificultad presentada por el estudio. Se sabe que las hembras alcanzan la madurez sexual cuando miden alrededor de 5,8 metros de longitud, mientras que los machos a los 5,5 metros. Aunque no existen estudios sobre la longevidad de esta especie, se cree que la edad máxima de los machos es de 36, mientras que en las hembras sería de unos 30 años de edad (Perrin et al., 2009).
La dificultad en su estudio ha hecho que no exista mucha información sobre su ecología, estructura social o su comportamiento. Sin embargo, en los últimos años ha habido varios estudios que han permitido empezar a entender un poco mejor la especie.
En diferentes partes del mundo se ha visto que forman grupos de pocos individuos, entre 1 y 15 en general, pero que pueden alcanzar hasta 25. El tamaño promedio del grupo varía entre 2.3 y 3.8 dependiendo de la zona o incluso dependiendo de la época del año (Carwardine, 2004; Baird et al., 2006; MacLeod and D’Amico, 2006; McSweeney et al., 2007 & Falcone et al., 2009). A veces puedes ver a individuos solitarios que suelen ser machos de edad avanzada.
El zifio de Cuvier es, probablemente, una de las especies de mamíferos marinos capaces de realizar las inmersiones en busca de alimento más largas y profundas, alcanzando registros de casi 1.900 metros de profundidad (Tyack et al., 2006). Parece que la especie haría tres tipos de diferentes inmersiones (Baird et al., 2006):
El ciclo de alimentación podría durar unas dos horas y estaría formado por un buceo profundo (segunda categoría) y un intervalo entre inmersiones profundas. Durante este intervalo de inmersiones se producen las categorías primera y tercera. Gracias a las grabaciones sonoras, se ha visto que en inmersiones profundas, el zifio de Cuvier muestra una gran actividad de ecolocación que comienza alrededor de 400-500 metros y se intensifica entre 500 y 1000 m, en zonas meso pelágica y batipelágica, donde se cree que se concentraría la alimentación de la especie (Tyack et al., 2006).
En general tienden a evitar las embarcaciones y raramente saltan fuera del agua, hechos que lo hacen más difícil de reconocer. En el mar se puede confundir con otras especies de la familia Ziphiidae como el zifio de Blainville (Mesoplodon densirostris) o Zifio de Gervais (Mesoplodon europaeus), pero estas otras dos especies no son tan comunes en el Mediterráneo y hay ciertas características que la diferencian del zifio de Cuvier (Shirihai and Jarret, 2006 & IUCN 2012):
A pesar de la dificultad en el estudio del zifio de Cuvier, debido a su naturaleza críptica, presentan diferentes características que permiten la diferenciación de cada uno de los individuos. En algunos casos la tasa de reavistamiento alcanza el 40%. Como en otros cetáceos, se han tenido que buscar las marcas permanentes, que permanecen estables en el tiempo, y que permitan reconocerlos cada vez que sean avistados. Entre estas características constan (McSweeney et al., 2007)
Aleta dorsal: SSe utiliza tanto la forma de la aleta dorsal como la presencia o ausencia de muescas en el margen posterior de la aleta.
Patrones de coloración: En general la coloración del zifio de Cuvier es altamente variable entre los individuos y las clases de edad. Los machos adultos tienden a mostrar grandes áreas blancas en la parte dorsal del cuerpo, por ejemplo. Estas diferencias pueden ser útiles cuando se trata de distinguir a individuos específicos.
Heridas: Muchos individuos de zifio de Cuvier presentan diversas heridas que permanecen más o menos estables en el tiempo. Aquellos que se encuentran cerca de la aleta dorsal o las zonas más dorsales del cuerpo se pueden utilizar para poder reconocer individualmente a diferentes animales.
A pesar de su dificultad para estudiarlo, la población mundial de zifio de Cuvier se estima en más de 100.000 individuos (Barlow, 2006a & Barlow et al., 2006b). La zona con una mayor abundancia sería el noroeste pacífico con unos 90,725 individuos, seguido por el este del Pacífico tropical, con unos 20.000 y las aguas que rodean a Hawái con 15,242 animales. Otras áreas tales como la costa occidental americana o al océano Atlántico tienen un número menor. Porque son con toda probabilidad el zifio más abundante y con un rango de distribución más grande, la Unión Internacional para la Conservación de la Naturaleza, lo ha clasificado bajo el estado de preocupación menor a escala mundial. En el Mediterráneo no hay mucha información sobre la abundancia de las especies. De hecho hay sólo dos estudios que han estimado su abundancia, en la zona de Génova y la parte norte del mar de Alborán. Hay algunos estudios que se están realizando y que se creen que son capaces de aportar información valiosa. Debido a esta falta de información sobre todo lo relacionado con la estructura de distribución, abundancia y población, la UICN ha clasificado el Zifio de Cuvier en el Mediterráneo bajo la condición de deficiente de datos. Las principales amenazas que afectan a las especies son:
Otro efecto que puede causar la exposición a sonidos es la alteración de la estructura de la población o de la distribución de una población de zifios de Cuvier en particular. Después del varamiento masivo de las Bahamas, un grupo de científicos que llevaban 9 años estudiando la población de la zona, fueron incapaces de volver a ver a ninguno de los individuos que habían sido identificados antes del lanzamiento. Pero no está claro si esto es debido a que todas los individuos murieron o que abandonaron la zona (Balcomb and Claridge, 2001).
Seguramente la naturaleza más oceánica de la especie lo hecho menos vulnerable a la actividad humana que se produce sobre todo en las costas, que generalmente es más invasivo para los cetáceos (pesca, turismo, etc.). En el mar Mediterráneo, la presencia del Santuario de Pelagos en el mar de Liguria y la reciente designación del área protegida del mar de Alborán, dos áreas importantes en la distribución de las especies, puede favorecer su conservación.
El zifio de Cuvier está protegido por varios acuerdos internacionales como el Apéndice II de la Convención sobre comercio internacional de especies amenazadas de Flora Silvestre y Fauna (CITES) o el acuerdo sobre la conservación de los cetáceos del mar negro, mar Mediterráneo y zona Atlántica adyacente (ACCOBAMS). El Comité científico del último cuerpo recomienda tener mucho cuidado o evitar totalmente la producción de sonidos subacuáticos en esos hábitats frecuentados por la especie o en áreas donde normalmente se concentran los cetáceos.
AZZELLINO, A., GASPARI, S., AIROLDI, S. & NANI, B. 2008. Habitat use and preferences of cetaceans along the continental slope and the adjacent pelagic waters in the Ligurian Sea. Deep-Sea Research. 55:296-323
BAIRD, R. W.; WEBSTER, D. L., MCSWEENEY, D. J., LIGON, A. D., SCHORR, G. S. & BARLOW, J. 2006. Diving behaviour of Cuvier’s beaked (Ziphius cavirostris) and Blainville’s (Mesoplodon densirostris) beaked whales in Hawai’i. Canadian Journal of Zoology. 84:1120-1128
BALCOMB, K. C. III & CLARIDGE, D.E. 2001. A mass stranding of cetaceans caused by naval sonar in the Bahamas. Bahamas Journal of Science. 8(2):2-12
BARLOW, J. 2006a. Cetaceans abundance in Hawaiian waters estimated from a summer/fall survey in 2002. Marine Mammal Science 22(2):446-464
BARLOW, J., FERGUSON, M. C., PERRIN, W. F., BALLANCE, L., GERRODETTE, T., JOYCE, G., MACLEOD, C. D., MULLIN, K., PALKA, D. L. & WARING, G. 2006b. Abundance and densities of beaked and bottlenose whales (family Ziphiidae). Journal of Cetacean Research and Management. 7(3):263-270
CAÑADAS, A., SAGARMINAGA, R. & GARCÍA-TISCAR S. 2002. Cetacean distribution related with depth and slope in the Mediterranean waters of southern Spain. Deep-Sea Research. 49:2053-2073
CARWARDINE, M. 2004. Ballenas delfines y marsopas. Ediciones Omega. Barcelona. 2ª reimpresión
COX, T. M., RAGEN, T. J., READ, A. J., VOS, E., BAIRD, R. W., BALCOMB, K., BARLOW, J., CALDWELL, J., CRANFORD, T., CRUM, L., D’AMICO, A., D’SPAIN, G., FERNANDEZ, A., FINNERAN, J., GENTRY, R., GERTH, W., GULLAND, F., HILDEBRAND, J., HOUSER, D., HULLAR, T., JEPSON, P. D., KETTEN, D., MACLEOD, C. D., MILLER, P., MOORE, S., MOUNDAIN, D. C., PALKA, D., PONGANIS, P., ROMMEL, S., ROWLES, T., TAYLOR, B., TYACK, P., WARTZOK, R. GISINER, MEAD, J., & BENNER, L. 2006. Understanding the impacts of anthropogenic sound on beaked whales. Journal of Cetacean Research and Management. 7(3):177-187
DERUTIER, S. L., SOUTHALL, B. L., CALAMBOKIDIS, J., ZIMMER, W. M. X., SADYKOVA, D., FALCONE, E. A., FRIEDLAENDER, A. S., JOSEPH, J. E., MORETTI, D., SCHORR, G. S., THOMAS, L. & TYACK, P. L. 2013. First direct measurements of behavioural responses by Cuvier’s beaked whales to mid-frequency active sonar. Biology Letters. 9:1-5
FALCONE, E. A., SCHORR, G. S., DOUGLAS, A. B., CALAMBOKIDIS, J., HENDERSON, E., MCKENNA, M. F., HILDEBRAND, J. & MORETI, D. 2009. Sighting characteristics and photo-identification of Cuvier’s beaked whales (Ziphius cavirostris) near San Clemente Island, California: a key area for beaked whales and the military? Marine Biology. 156:2631-2640
FERNÁNDEZ, A. 2004. Pathological findings in stranded beaked whales during the naval military manoeuvres near the Canary Islands. In: EVANS, P. G. H. & MILLER, L. A. (eds). 2004. Proceedings of the Workshop on Active Sonar and Cetaceans. Las Palmas, Gran Canaria, 8th March 2003, European Cetacean Society Newsletter, Nº 42. Special Issue
FERNÁNDEZ, A., EDWARDS, J. F., RODRÍGUEZ, F., ESPINOSA DE LOS MONTEROS, A., HERRÁEZ, P., CASTRO, P., JABER, J. R., MARTÍN, V. & ARBELO, M. 2005. “Gas and Fat Embolic Syndrome” involving a mass stranding of beaked whales (Family Ziphiidae) exposed to anthropogenic sonar signals. Veterinary Patology. 42:446-457
FISCUS, C. H. 1997. Cephalod beaks in a cuvier’s beaked whale (Ziphius cavirostris) from Amchitka Island, Alaska. Marine Mammal Science. 13(3):481-486
FRANTZIS, A. 1998. Does acoustic testing strand whales? Nature. 392:29-30
FRANTZIS, A., ALEXIADOU, P., PAXIMADIS, G., POLITI., E., GANNIER, A. & CORSINI-FOKA, M. 2003. Current knowledge of the cetacean fauna of the Greek Seas. Journal of Cetacean Research and Management. 5(3):219-232
FRANTZIS, A. 2004a. The first mass stranding that was associated with the use of active sonar (Kyparissiakos Gulf, Greece, 1996). In: EVANS, P. G. H. & MILLER, L. A. (eds). 2004. Proceedings of the Workshop on Active Sonar and Cetaceans. Las Palmas, Gran Canaria, 8th March 2003, European Cetacean Society Newsletter, Nº 42. Special Issue
FREITAS, L. 2004. The stranding of three Cuvier’s beaked whales Ziphius cavirostris in Madeira Archipelago – May 2000. In: EVANS, P. G. H. & MILLER, L. A. (eds). 2004. Proceedings of the Workshop on Active Sonar and Cetaceans. Las Palmas, Gran Canaria, 8th March 2003, European Cetacean Society Newsletter, Nº 42. Special Issue
GANNIER, A. & ESPINAT, J. 2008. Cuvier’s beaked whale distribution in the Mediterranean Sea: results from small boat surveys 1996 – 2007. Journal of the Marine Biological Association of the United Kingdom. 88(6):1245-1251
GANNIER, A. 2011. Using existing data on focused surveys to highlight Cuvier’s beaked whales favourable areas: A case study in the central Tyrrenian Sea. Marine Pollution Bulletin. 63:10-17
HOLCER,D., NOTARBARTOLO DI SCIARA, G., FORTUNA, C. M., LAZAR, B. & ONOFRI, V. 2007. Occurence of Cuvier’s beaked whales in the southern Adriatic Sea: evidence of an important Mediterranean habitat. Journal of the Marine Biological Association of the United Kingdom. 87:359-362
IUCN 2012. Marine Mammals and Sea Turtles of the Mediterranean and Black Seas. Gland, Switzerland and Malaga, Spain: IUCN. 32 pages.
JEFFERSON, T. A., WEBBER, M. A. & PITMAN, R. L. 2008. Marine mammals of the world: A comprehensive guide to their identification. Academic Press. Canadà
MACLEOD, C. D., SANTOS M. B. & PIERCE G. J. 2003. Review of data on diets of beaked whales: evidence of niche separation and geographic segregation. Journal of the Marine Biological Association of the United Kingdom. 83:651-665
MACLEOD, C. D. & D’AMICO, A. 2006. A review of beaked whale behaviour and ecology in relation to assessing and mitigating impacts of anthropogenic noise. Journal of Cetacean Research and Management. 7(3):211-221
MARTÍN, V., SERVIDIO, A. & GARCÍA, S. 2004. Mass stranding of beaked whales in the Canary Islands. In: EVANS, P. G. H. & MILLER, L. A. (eds). 2004. Proceedings of the Workshop on Active Sonar and Cetaceans. Las Palmas, Gran Canaria, 8th March 2003, European Cetacean Society Newsletter, Nº 42. Special Issue
MCSWEENEY, D. J., BAIRD, R. W. & MAHAFFY, S. D. 2007. Site fidelity, associations and movements of Cuvier’s (Ziphius cavirostris) and Blainville’s (Mesoplodon densirostris) beaked whales off the island of Hawai’i. Marine Mammal Science. 23(3):666-687
NOTARBARTOLO DI SCIARA, G. 2002. Cetacean species occurring in the Mediterranean and Black Seas. In: G. NOTARBARTOLO DI SCIARA (Ed.), Cetaceans of the Mediterranean and Black Seas: state of knowledge and conservation strategies. A report to the ACCOBAMS Secretariat, Monaco, February 2002. Section 3, 17 p.
NOTARBARTOLO DI SCIARA, G. & BIRKUN A JR. 2010. Conserving whales and dolphins in the Mediterranean and Black seas. An ACCOBAMS status report. ACCOBAMS, Monaco. 212 p
PERRIN, W. F., WÜRSIG, B. & THEWISSEN, J. G. M. 2009. Encyclopedia of marine mammals. Second edition. Academic Press. United States of America
PODESTÀ, M., D’AMICO, A., PAVAN, G., DROUGAS, A., KOMMENOU, A. & PORTUNATO, N. 2006. A review of Cuvier’s beaked whale strandings in the Mediterranean Sea. Journal of Cetacean Research and Management. 7(3):251-261
REEVES, R. & NOTARBARTOLO DI SCIARA, G. 2006. The status and distribution of cetaceans in the Black Sea and Mediterranean Sea. IUCN Centre for Mediterranean Cooperation, Malaga, Spain. 137 pp.
SANTOS, M. B., PIERCE, G. J., HERMAN, J., LÓPEZ, A., GUERRA, A., MENTE, E. & CLARKE, M. R. 2001. Feeding ecology of Cuvier’s beaked whale (Ziphius cavirostris): a review with the information on the diet of this species. Journal of the Marine Biological Association of the United Kingdom. 81:687-694
SHIRIHAI, H & JARRET, B. 2006. Whales dolphins and seals: A field guide to the marine mammals of the world. A & C Black, London
SMITH, J. 2010. The ecology of Cuvier’s beaked whale, Ziphius cavirostris (Cetacea: Ziphiidae), in the Bay of Biscay. University of Southampton, UK, Graduate School of the National Oceanography Centre, PhD Thesis, 214 pp.
TAYLOR, B.L., BAIRD, R., BARLOW, J., DAWSON, S.M., FORD, J., MEAD, J.G., NOTARBARTOLO DI SCIARA, G., WADE, P. & PITMAN, R.L. 2008. Ziphius cavirostris. In: IUCN 2013. IUCN Red List of Threatened Species. Version 2013.2.
TYACK, P. L., JOHNSON, M., AGUILAR SOTO, N., STURLESE, A. & MADSEN, P. T. 2006. Extrem diving of beaked whales. The Journal of Experimental Biology. 209:4238-4253
http://www.iucnredlist.org/details/16381144/0
http://www.iucnredlist.org/details/23211/0
http://www.accobams.org/
http://www.cites.org/esp/
http://www.cms.int/